Réponse physiologique de bactéries marines lors de leur fixation d’azote
Publié par Nantes Université, le 7 novembre 2024 890
Article écrit par François Delavat, Maître de conférences au laboratoire US2B de Nantes Université (Unité en Sciences Biologiques et Biotechnologies)
Quand on pense au comportement social, on pense souvent à certains animaux comme les abeilles ou les fourmis. Au sein de leurs colonies, chaque individu aura une tâche à accomplir, qui sera différente de celle d’un autre individu. C’est cette répartition des tâches qui va permettre à la colonie de fonctionner correctement et de se développer. Tandis que ce comportement social est très connu chez certains animaux, je m’intéresse à un monde peu exploré : celui des bactéries. Est-ce que ces organismes unicellulaires et microscopiques sont également capables d’adopter un comportement social ? Pour répondre à ces questions, je m’intéresse à des bactéries marines méconnues mais ayant un rôle écologique extrêmement important : elles sont capables de transformer la molécule majoritaire dans l’air mais non-utilisable par la majorité des êtres vivants, le diazote (N2), en une molécule qui peut être utilisée par l’immense majorité des êtres vivants, l’ammoniac, dans un processus appelé fixation de N2 ou diazotrophie. Le but de ce projet était de comprendre la réponse physiologique de ces bactéries diazotrophes (appelées DNC) lors de carence en azote, et notamment lors de la fixation de N2, en faisant un focus particulier sur le comportement social de celles-ci.
Les travaux, résumés ici, n’auraient pas pu être obtenus sans l’encadrement de nombreuses personnes, qui sont citées dans les publications présentées à la fin de ce billet. Ils ont été réalisés au sein de l’US2B (Unité en Sciences Biologiques et Biotechnologie) de Nantes Université.
Nous avons tout d’abord testé les capacités génétiques de Pseudomonas stutzeri BAL361 et Vibrio diazotrophicus NS1, deux DNC marines isolées. Nous avons cherché à développer des outils de mutagenèse pour ces souches. Il s’est avéré que P. stutzeri BAL361 se révèle compliquée à travailler génétiquement parlant, alors que les mutations génétiques constituent la base du projet. Au contraire, nous avons développé des outils génétiques, par conjugaison et électroporation, pour transférer des plasmides conjugatifs chez V. diazotrophicus NS1 (Figure 1).
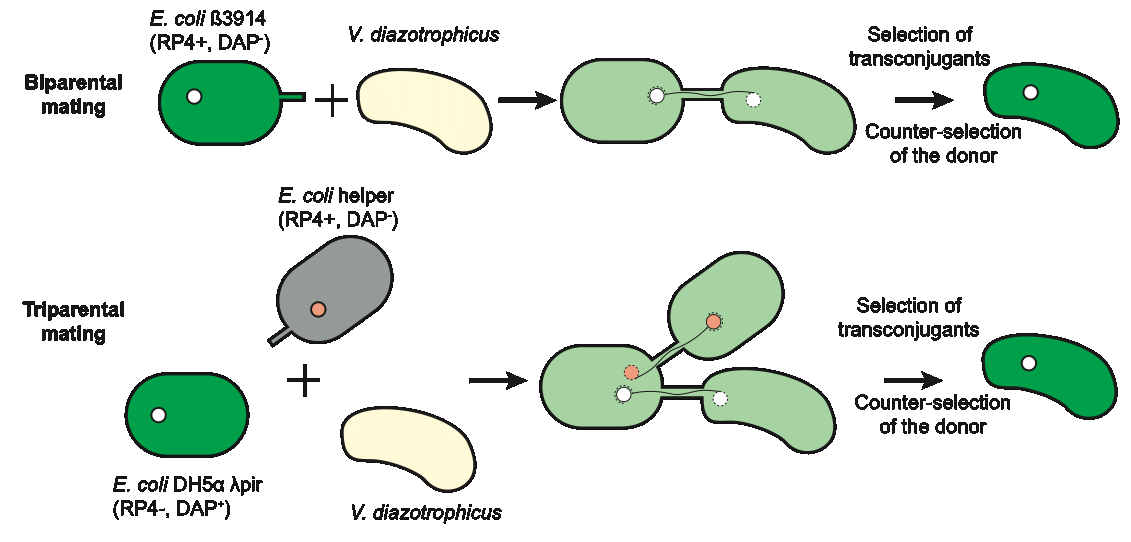
Figure 1. Présentation de deux outils de mutagenèse par conjugaison chez V. diazotrophicus NS1
De plus, ces outils ont permis la délétion du gène nifH, codant une des sous-unités de la nitrogénase et indispensable à la fixation de N2. Ainsi, tandis que l’utilisation de P. stutzeri BAL361 comme souche modèle est pour l’instant mise de côté, il s’avère que V. diazotrophicus NS1 se révèle une souche particulièrement prometteuse pour étudier l’écophysiologie des DNC marines.
Nous avons ensuite développé un test phénotypique, permettant de cribler des mutants sur la base de leur capacité à croître an absence d’azote hors N2. Un test en « softgellan » a ainsi été développé, permettant la croissance en absence d’azote pour la souche sauvage, tandis que le mutant nifH se révèle incapable de croître dans ces conditions (Figure 2). Une collaboration avec B. Jesus (ISOMER, Nantes) nous a permis de montrer que l’anneau de croissance se trouve être à une concentration faible mais non-nulle en dioxygène (O2). La croissance en micro-aérobie semble donc être une condition favorisant la diazotrophie chez cette souche.

Figure 2. Test de croissance en softgellan dans un milieu dépourvu d’azote. La présence d’un anneau de croissance est matérialisée par une flèche blanche, absence chez le mutant nifH. « nifH-compl » est le mutant nifH dans lequel le gène nifH a été-introduit, restaurant le phénotype sauvage.
Dans ce milieu en softgellan, nous avons également pu montrer, par microscopie à épifluorescence, que les cellules sont principalement sous forme unicellulaires au sein de l’anneau de croissance. La question suivante était : comment créer cette condition de micro-aérobie dans un environnement majoritairement aérobie ? Nous avons pu montrer que V. diazotrophicus NS1 produit un épais biofilm, et que la matrice du biofilm permet de limiter la concentration en O2, créant probablement des conditions micro-aérobie favorables à la fixation de N2 (Figure 3). L’épaisseur du biofilm a été mesurée par une approche de microscopie confocale, via une collaboration avec des membres du LBCM (Univ Bretagne Sud). Il est à noter que la production de biofilm est considérée comme un comportement collectif chez les bactéries, comportement typiquement régulé par de la communication inter-bactérienne pour produire cette structure tri-dimensionnelle. Ainsi, nos travaux montrent que la bactérie diazotrophe V. diazotrophicus NS1 adopte un comportement social, via la production de biofilm, pour se construire elle-même un micro-environnement susceptible de favoriser la diazotrophie.
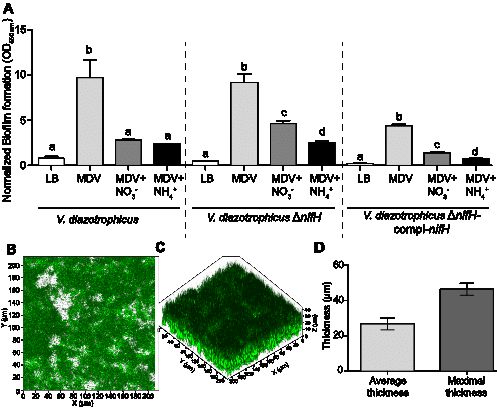
Figure 3. Production de biofilm par V. diazotrophicus (A) biofilm produit en microplaque dans différentes conditions de croissance. (B) photographie en microscopie confocale du biofilm produit par V. diazotrophicus en chambre en flux. (C) vue en 3D du biofilm produit par la souche. (D) quantification de l’épaisseur du biofilm.
Enfin, nous montrons que d’autres souches de V. diazotrophicus sont retrouvées dans la nature, et que chacune de ces souches possède un cluster de gènes nif relativement similaire, malgré des origines géographiques très différentes.
L’ensemble de ces résultats a été publié dans la revue Environmental microbiology en 2022.
A. Joublin-Delavat, K. Touahri, P. Crétin, A. Morot, S. Rodrigues, B. Jesus, F. Trigodet, F. Delavat. Genetic and physiological insights into the diazotrophic activity of a non-cyanobacterial marine diazotroph. Environmental Microbiology 2022, 24, 6510-6523.
Cette étude permet de poser les bases pour établir V. diazotrophicus comme modèle d’étude de DNC marines. Dans ce 2nd temps, il s’agissait de développer des biorapporteurs pour cette souche. Un biorapporteur est un gène rapporteur comme le gène gfp, dont l’expression reflètera l’activité d’un promoteur dédié. Cependant, les conditions expérimentales nous obligent à travailler en microaérobie en softgellan pour étudier la diazotrophie. Cette zone est extrêmement limitée au sein du tube, ce qui implique que certaines cellules étudiées se retrouvent sous l’anneau et donc en absence d’oxygène. Cette croissance en anoxie est un problème pour l’utilisation des biorapporteurs, puisque les protéines de fluorescence comme la GFP nécessite de l’O2 pour fluorescer. C’est la raison pour laquelle nous avons développé une série de plasmides1, variant en termes de promoteurs utilisés, site de fixation au ribosome2 et distance entre les deux, permettant l’expression d’un nouveau gène rapporteur, appelé kofp-7, dont la protéine fluoresce de manière indépendante de l’O2. Nous avons notamment développé ce type de plasmides pour des utilisations chez différentes souches bactériennes, de Escherichia coli, des Pseudomonas, des Rhizobiaceae et également des Vibrio comme V. diazotrophicus NS1. Ces résultats ont permis de faire ressortir le plasmide pFD145, capable de se maintenir dans E. coli et dans des souches du genre Vibrio, comme plasmide extrêmement intéressant, permettant une fluorescence cellulaire en anoxie avec du nitrate (Figure 4B) comme accepteur terminal d’électrons ou du glucose lors de la fermentation ((Figure 4C).
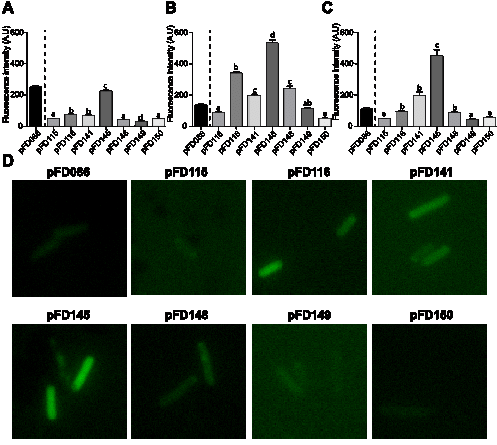
Figure 4. Intensité de fluorescence cellulaire due à la présence de différents plasmides dans E. coli. Données obtenues par microscopie à épifluorescence. (A) Fluorescence obtenue après croissance en LB en anoxie. (B) Fluorescence obtenue après croissance en LB + nitrate en anoxie. (C) Fluorescence obtenue après croissance en LB + glucose. (D) photo de cellules portant différents plasmides, après croissance en LB + nitrate.
Ces travaux ont donné lieu à une publication, parue dans Microbiology spectrum en 2024.
E. Agranier, P. Crétin, A. Joublin-Delavat, L. Veillard, K. Touahri and F. Delavat. Development and utilization of new O2-independent bioreporters. Microbiology Spectrum 2024, e0409123
En plus de ces deux articles en dernier auteur, mes travaux sur la génétique des Vibrio ont permis la mise en place de collaborations, permettant d’être co-auteur pour 2 articles, dont un paru dans PNAS :
D. Oyanedel, A. Lagorce, M. Bruto, P. Haffner, A. Morot, (…) F. Delavat, (…), and D. Destoumieux-Garzón. Cooperation and cheating orchestrate Vibrio assemblages and polymicrobial synergy in oysters infected with OsHV-1 virus. Proceedings of the National Academy of Sciences of the United States of America 2023, 120(40) e2305195120
M. Sorée, F. Delavat, C. Lambert, S. Lozach, M. Papin, B. Petton, D. Passerini, L. Dégremont, D. Hervio-Heath. Life-history of oysters influence Vibrio parahaemolyticus accumulation in Pacific oysters (Crassostrea gigas). Environmental Microbiology
Ainsi, le projet SMIDIDI a permis d’établir V. diazotrophicus NS1 comme un modèle d’étude des bactéries diazotrophes marines, et ont permis de lever le voile sur l’écophysiologie de celles-ci. Ces résultats vont avoir un impact important sur la compréhension de la biologie de ces bactéries, et plus encore sur les cycles du carbone et de l’azote dans les océans, car ces bactéries participent à la transformation de ces éléments importants à la vie.
Lexique
- Plasmide : ici, petit ADN bactérien facilement manipulable en laboratoire
- Ribosome : Complexe permettant la synthèse de protéines



