Microbiote intestinal et santé, une alliance que chacun peut optimiser
Publié par Hélène Biton, le 21 décembre 2021 970
Microbiote intestinal et santé, une alliance que chacun peut optimiser
Malvyne Rolli-Derkinderen, Université de Nantes

Cet article est publié dans le cadre de la Fête de la science, qui a lieu du 1er au 11 octobre 2021 en métropole et du 5 au 22 novembre 2021 en outre-mer et à l’international, et dont The Conversation France est partenaire. Cette édition a pour thème : « Eureka ! L’émotion de la découverte ». Retrouvez tous les événements de votre région sur le site Fetedelascience.fr.
Depuis quelques années, c’est une star des laboratoires qui s’est frayé un chemin jusqu’au grand public… Le microbiote intestinal, puisqu’il s’agit de lui, se voit paré de nombreuses vertus sinon de pouvoirs intrigants et pas toujours bénéfiques : que ce soit dans le contexte de maladies purement digestives ou de maladies neurologiques ou psychiatriques, il est maintenant considéré comme un acteur à part entière du développement de certaines pathologies.
De plus, étant facilement accessible, paraissant facilement analysable ou modifiable, les scientifiques se posent la question : s’il peut induire des pathologies, pourrait-il également contribuer à les guérir ou encore prévenir leur apparition ? Jusqu’où pourrons-nous l’utiliser pour améliorer notre santé ?
Pour répondre, il faut repréciser brièvement ce qu’est un microbiote : un ensemble complexe, composés d’une large et variée cohorte de micro-organismes, comprenant des bactéries, des champignons, des virus et des archées. Un microbiote est également intégré à un écosystème : il peut donc exister autant de microbiotes que d’écosystèmes… d’où la nécessité d’en préciser les contours. Et de rappeler que chacun de nos organes en contact avec un milieu extérieur (pas seulement l’intestin) a son propre microbiote – peau, bouche, poumons, etc. Tous ensemble, ils forment le microbiote humain.
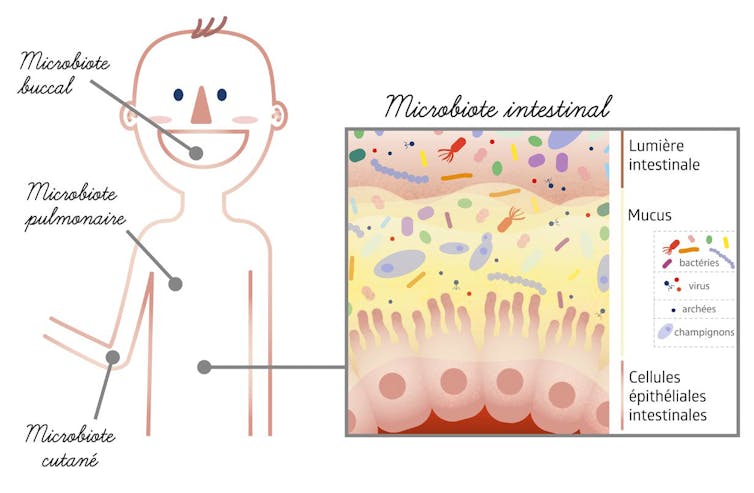
L’importance de ces microbiotes tient en partie au fait que leurs microorganismes se développent à une place stratégique : à la lisière de nos organes, où ils constituent une zone tampon entre milieu intérieur et milieu extérieur. Par leurs interactions avec nos cellules, ils sont capables d’amortir les variations de ces environnements et représentent souvent le premier moyen d’exclusion des pathogènes. Le microbiote intestinal, par exemple, interagit avec les cellules externes (ou barrière épithéliale) de l’intestin, le système immunitaire et le système nerveux entérique (partie du système nerveux autonome qui contrôle le système digestif).
Notre corps leur offre un lieu de vie en contrepartie d’une assistance bénéfique dans bien des cas. Mais un déséquilibre va contribuer, ou peut même être à l’origine du développement de maladies chroniques. S’il paraîtrait facile de rétablir l’équilibre en corrigeant le microbiote impliqué, n’oublions pas l’influence des autres plateaux de la balance : l’hôte et l’environnement externe.
Le poids du microbiote intestinal sur notre santé
Le microbiote intestinal contient 1014 bactéries et 100 fois plus de gènes que l’ensemble du génome humain. Il joue un rôle essentiel dans le développement du système immunitaire, du système nerveux et du métabolisme de son hôte.
Un millier d’espèces bactériennes, appartenant à cinq phyla principaux(Bacteroidetes, Firmicutes, Actinobacteria, Proteobacteria et Verrucomicrobia), composent le microbiote fécal humain sain. Sa composition est essentielle au maintien de l’homéostasie intestinale et reflète, dans une mesure variable, la santé globale de l’hôte.
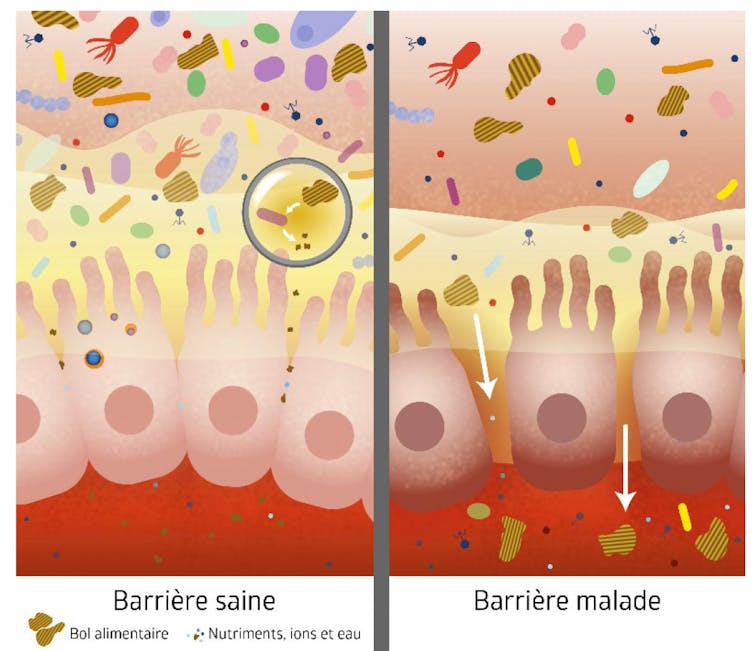
Un groupe de chercheurs ligériens a focalisé ses recherches sur la régulation des barrières d’organes où s’installent les microbiotes et leurs relations (le projet MiBiogate). Si ces barrières ne sont pas hermétiques, elles sont traversées de façon très contrôlée chez les individus en bonne santé. Dans notre intestin, c’est la couche de cellules de l’épithélium digestif qui constitue cette barrière plus ou moins poreuse. Sa perméabilité est régulée selon son état propre ainsi que celui du microbiote intestinal, du système immunitaire et du système nerveux entérique.
Des dysfonctions sont observées dans différentes pathologies digestives (maladies inflammatoires chroniques de l’intestin) ou extra-digestives (diabètes de type 2, obésité, troubles du spectre autistique, maladie de Parkinson). Or, ces pathologies sont elles-mêmes associées à une « dysbiose » : une altération de la composition et des fonctions du microbiote intestinal.
De nombreux travaux cherchent donc à déterminer à quel point, en améliorant notre microbiote, nous pourrions renforcer notre barrière, et ainsi notre santé.
Des interactions fondamentales
En 2013, de premières études mettent en cause la dysbiose dans la genèse de pathologies comme l’obésité ou la stéatose hépatique non alcoolique, en montrant que l’implantation d’un microbiote de souris malade à une souris saine va y entraîner le développement de caractères pathologiques.
Inversement, le New England Journal of Medicine rapporte une étude montrant que la transplantation de matière fécale saine est efficace, dans la grande majorité des cas, pour soigner une infection par la bactérie Clostridium difficile. Cette bactérie se développe suite à un appauvrissement du microbiote, souvent après une antibiothérapie, et provoque de graves diarrhées, des inflammations du système digestif. Près de 14 000 Américains en meurent chaque année.
Depuis, de nombreux travaux cherchent à comprendre les interactions hôte-microbiote. Le consortium Mibiogate met ainsi en commun les expertises et outils de ses spécialistes. Ce qui lui a, par exemple, permis d’observer que des vésicules issues des bactéries pouvaient contribuer à l’aggravation de pathologies métaboliques, telles que la stéatose hépatique non alcoolique qui peut évoluer en cirrhose.
Grâce à cinq projets de thèses, le consortium Mibiogate élargit son regard et son champ de recherche. Sont désormais étudiées les interactions microbiote-barrières de divers organes grâce, notamment, au développement d’outils bioinformatiques et applications. Des outils qui ouvrent la porte à un pan de la connaissance encore inexploré relevant de ces interactions.
Des recherches pour contrôler notre microbiote
En plus de l’étude de ses interactions, Mibiogate adresse les questions de « comment ? » et « quand ? » intervenir pour les améliorer ou les rétablir de manière efficace.
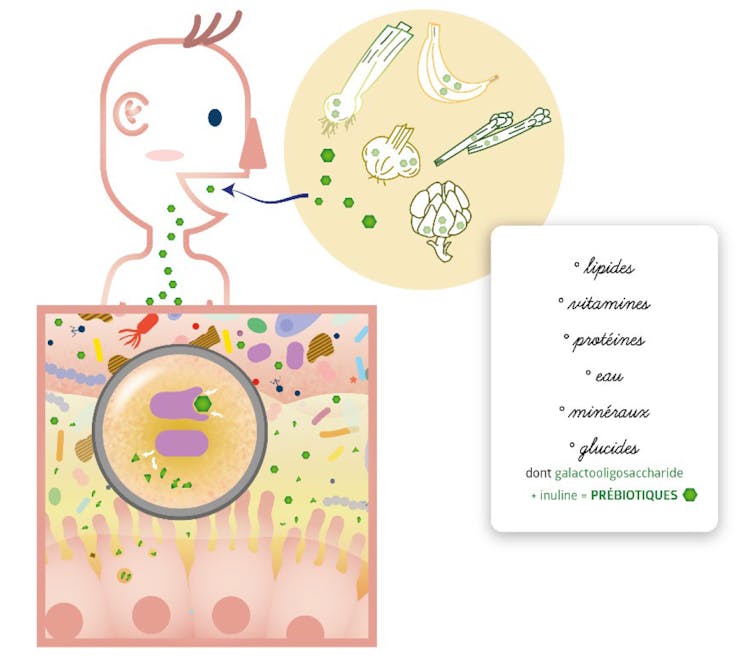
Concernant le « comment » déjà. Différentes stratégies de modulation ou de contrôle du microbiote existent : par l’alimentation, des prébiotiques ou des cocktails de probiotiques. En plus de ces méthodes directes, il faut prendre en compte que notre état de stress, la qualité de notre sommeil et notre activité physique, puis qu’en changeant l’activité du fermenteur que nous sommes, nous allons modifier nos microbiotes. Ces stratégies d’enrichissement globales sont complétées par l’utilisation de produits issus du microbiote, les post-biotiques, qui devraient avoir une efficacité supérieure et plus ciblée, mais tout cela est encore à l’étude.
Pour le « Quand » : déterminer l’origine du développement des maladies chroniques afin de comprendre pourquoi, comment et quand on peut en prendre la direction est une importante voie de recherche en cours. En caractérisant les fenêtres temporelles qui déterminent la composition et l’activité du microbiote intestinal, l’objectif est de pouvoir proposer des solutions thérapeutiques adaptées et surtout des stratégies préventives.
Notre hypothèse serait qu’un défaut dans son bon établissement pourrait sous-tendre le développement de pathologies futures. En effet, les maladies chroniques mettent longtemps à s’installer et bien souvent les malades ne présentent pas de symptômes avant plusieurs années : on peut supposer qu’elles aient une origine précoce, dès le stade fœtal. C’est le concept de l’origine développementale de la santé et des maladies (DOHaD).
De nombreuses recherches tendent en effet à montrer qu’il existe un lien entre une exposition à des facteurs environnementaux au cours des 1000 premiers jours de vie (de la conception aux deux ans de l’enfant) et la survenue d’une maladie chronique. Ces recherches suggèrent notamment que c’est alors que les composants du microbiote, du système immunitaire et du métabolisme de l’hôte peuvent être modulés et interagir différemment pour protéger ou provoquer le développement de ces maladies à l’âge adulte. C’est à ce moment-là qu’il faudrait agir pour établir durablement les compositions des microbiotes.
À l’âge adulte, on observe une résilience du microbiote intestinal lorsqu’il a pu s’établir correctement : s’il peut être modifié par un facteur environnemental (stress, alimentation, tabac, activité physique, pollution, antibiothérapies…), il retrouve sa signature initiale, caractéristique de son hôte, peu de temps après l’éviction du facteur environnemental perturbant.
Vous l’aurez compris, adopter la bonne stratégie pour moduler son microbiote et éviter de développer une maladie chronique en est encore à ses balbutiements. Néanmoins, un caractère commun à de nombreuses études, est que la pauvreté de notre microbiote est associé à différents états pathologique, alors que sa richesse et sa diversité reflètent la résistance d’un organisme et son caractère sain. Cultivons notre microbiote !
Le projet Mibiogate a été porté par Michel Neunlist, directeur de l’UMR1235 TENS. Carine Gimbert, gestionnaire projet Mibiogate (Inserm) et médiatrice scientifique, a participé à la conception et la rédaction de cet article.
Éléonore Dijoux, Amélie Lê, Aurélie Loussouarn, Alexandre Villard et Johanna Zoppi ont contribué à l’apport de cette connaissance scientifique en effectuant leur thèse au sein du projet Mibiogate.![]()
Malvyne Rolli-Derkinderen, Docteur, spécialisée en neurogastroentérologie. Domaine d'expertise : les maladies inflammatoires chroniques de l'intestin, Université de Nantes
Cet article est republié à partir de The Conversation sous licence Creative Commons. Lire l’article original.




